Múltiplas interações tridimensionais são possíveis entre moléculas e entre grupos na mesma molécula. Um dos efeitos mais notáveis é o impedimento estérico que é a repulsão espacial entre grupos volumosos.
Entretanto, como as moléculas são desenhadas em duas dimensões, algumas interações podem ser difíceis de serem identificadas. Para facilitar a compreensão dos fenômenos tridimensionais em duas dimensões foram desenvolvidas as fórmulas de projeção em perspectiva.
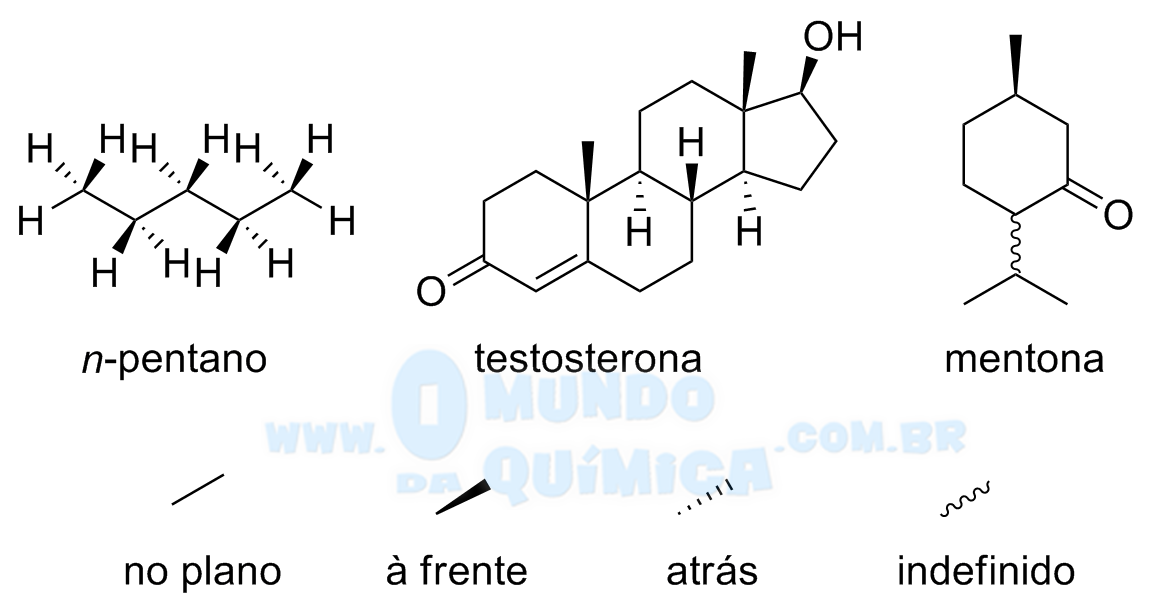
Projeção em Cunha
A projeção em cunha é a representação mais simples, onde as linhas retas são ligações no plano, as cunhas preenchidas são ligações projetadas para fora no plano e as cunhas hachuradas são ligações projetadas para dentro no plano. A ligação ondulada se refere ao desconhecimento da posição exata da ligação, podendo estar á frente ou atrás no plano e as ligações entre hidrogênio e carbono podem ser omitidas. A preferência para as ligações no plano são para a cadeia principal ou para ciclos.
Projeção em Cavalete
A projeção em cavalete utiliza a estrutura da fórmula em bastão com cunhas no plano ou em perspectiva para analisar a ligação entre dois centros e as posições relativas entre os substituintes. Assim, centrando a análise do n-hexano entre C3 e C4, teremos como possibilidades:
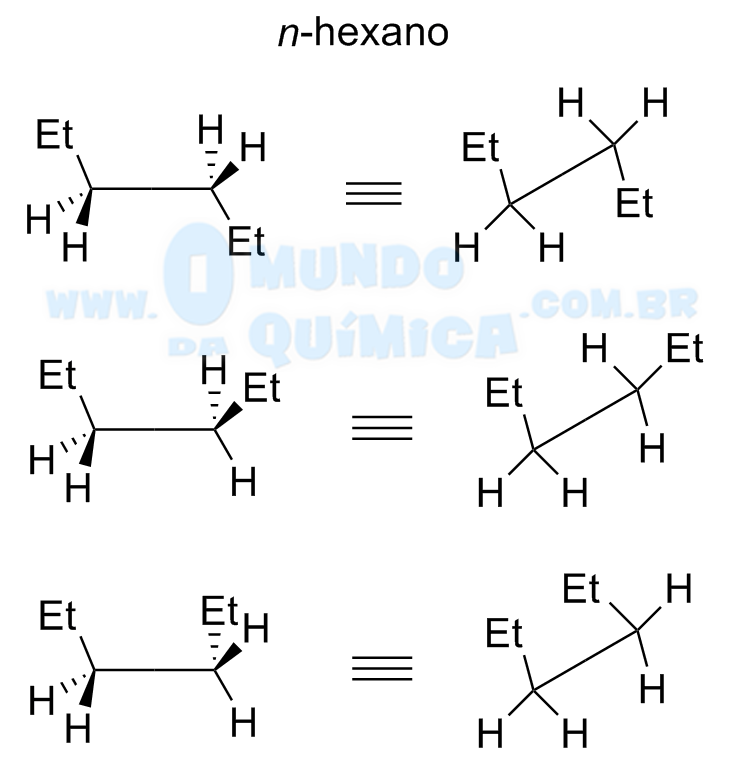
Cada uma das possibilidades é chamada de confôrmero e contribuiu para a descrição da molécula, tanto estruturalmente quanto em termos de energia. A projeção em cavalete permite analisar os efeitos estéricos em perspectiva entre as diferentes conformações, sendo as de menor energia aquelas em que houver menor efeito estérico.
Projeção de Haworth
A projeção de Haworth tem grande uso em química e bioquímica, sendo uma projeção com efeito tridimensional focada em ciclos. Os ciclos são posicionados em perspectiva com as ligações mais próximas com espessura maior.
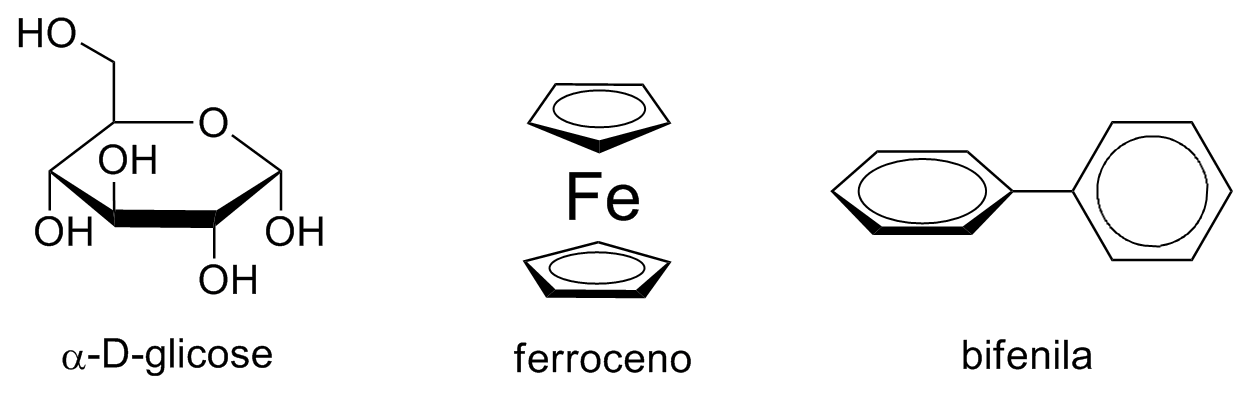
Carbonos e hidrogênios são implícitos e as posições equatorial e axial são representadas como ligações para cima e para baixo 180º uma da outra. Anéis aromáticos também podem ser representados para demonstrar suas posições relativas.
Projeção de Newman
A projeção de Newman pode ser descrita como a análise ortogonal entre dois carbonos que se ligam, ou seja, é uma visão ortogonal da projeção em cavalete. A análise através da projeção de Newman permite analisar de maneira mais intuitiva os efeitos estéricos sobre cada um dos confôrmeros.
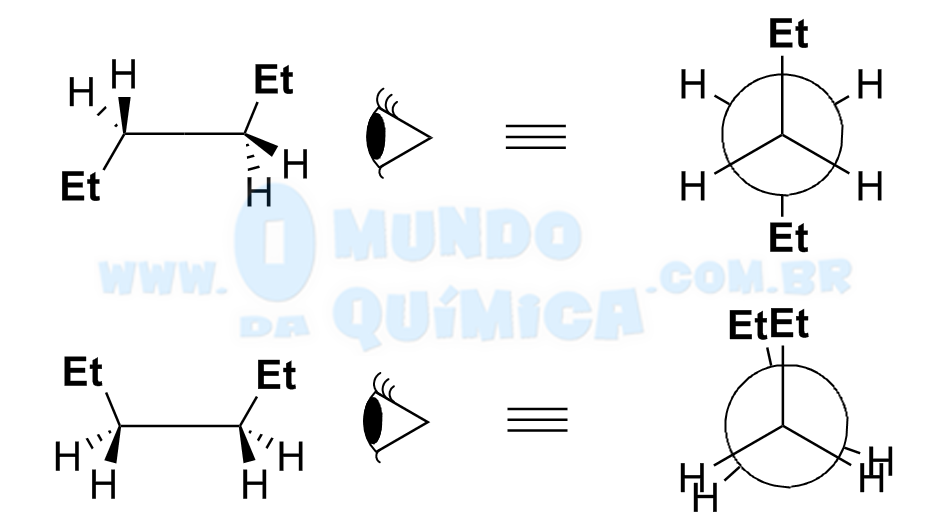
Logo após a projeção de Newman ser feita é necessário identificar qual é o grupo mais volumoso (num primeiro momento o raio atômico é uma boa aproximação) nas porções anterior e posterior. Os grupos mais volumosos se repelem estericamente com mais intensidade, de modo que suas posições relativas afetam a energia da molécula.
Projeção de Fisher
A projeção de Fisher foi desenvolvida para estudar os isômeros de carboidratos e essa é a sua principal utilização. Como a projeção de Fischer não possui intuito de visualização tridimensional, a transformação de outras projeções para a de Fisher deve ser feita com muito cuidado para evitar confusões e erros. Utilizando o 3,4-dibromo-hexano em projeção cavalete como exemplo, o primeiro passo é a passagem para a posição com as etilas eclipsadas.
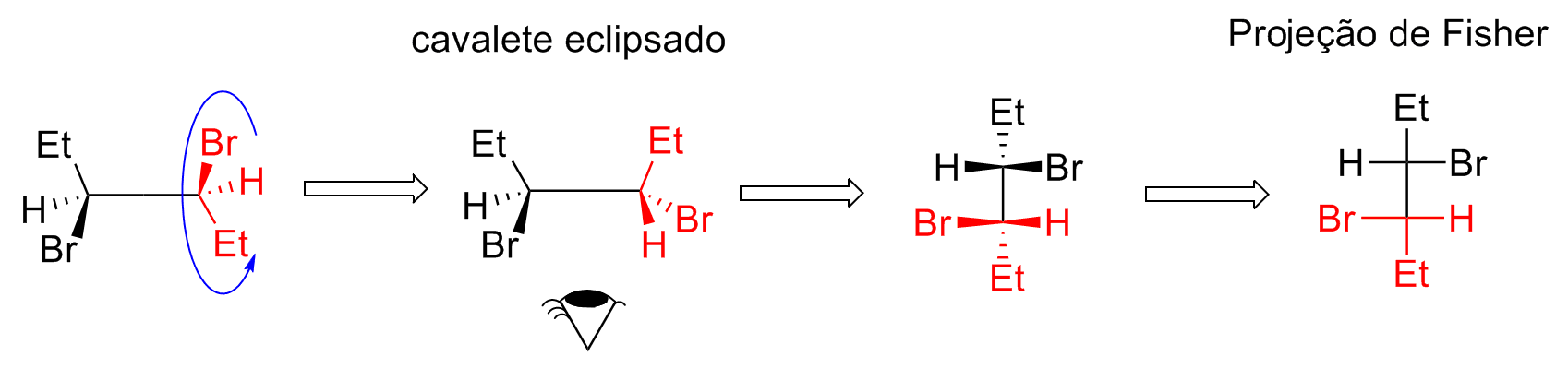
Em seguida, a molécula deve ser visualizada de modo que as etilas fiquem na vertical, para dentro no plano, levando as ligações atrás e a frente do plano em cavalete para esquerda e direita em Fisher, respectivamente. O próximo passo é simplesmente “achatar” as ligações no plano e a transformação para a projeção de Fisher está concluída.
Os cruzamentos de linhas são carbonos e o hidrogênio deve ser representado. A projeção de Fisher deve sempre ser manipulada no plano, com rotações de 180º, e qualquer outra rotação levará a equívocos.
